ESTEQUIOMETRÍA
Reacción química y
ecuaciones químicas
Una Reacción química es un proceso en el cual una sustancia (o
sustancias) desaparece para formar una o más sustancias nuevas.
Las ecuaciones químicas son el modo de representar a las
reacciones químicas.
Por ejemplo el hidrógeno gas (H2) puede reaccionar con
oxígeno gas (O2) para dar agua (H20). La ecuación química
para esta reacción se escribe:
El "+" se lee como "reacciona con"
La flecha significa "produce".
Las fórmulas químicas a la izquierda de la flecha representan las
sustancias de partida denominadas reactivos.
A la derecha de la flecha están las formulas químicas de las sustancias
producidas denominadas productos.
Los números al lado de las formulas son los coeficientes (el
coeficiente 1 se omite).
Estequiometria
de la reacción química
Ahora estudiaremos la estequiometria, es decir la medición de los
elementos).
Las transformaciones que ocurren en una reacción química se rigen por la
Ley de la conservación de la masa: Los átomos no se crean ni se destruyen
durante una reacción química.
Entonces, el mismo conjunto de átomos está presente antes, durante y
después de la reacción. Los cambios que ocurren en una reacción química
simplemente consisten en una reordenación de los átomos.
Por lo tanto una ecuación química ha de tener el mismo número de
átomos de cada elemento a ambos lados de la flecha. Se dice entonces
que la ecuación está balanceada.
2H2
|
+
|
O2
|
2H2O
|
|
Reactivos
|
Productos
|
|||
4H
|
y
|
2O
|
=
|
4H + 2O
|
Pasos que son necesarios para escribir una reacción
ajustada:
1) Se determina cuáles son los reactivos y los
productos.
2) Se escribe una ecuación no ajustada usando las
fórmulas de los reactivos y de los productos.
3) Se ajusta la reacción determinando los
coeficientes que nos dan números iguales de cada tipo de átomo en cada lado de
la flecha de reacción, generalmente números enteros.
Ejemplo 1:
Consideremos la reacción de combustión del metano gaseoso (CH4)
en aire.
Paso 1:
Sabemos que en esta reacción se consume (O2) y produce agua
(H2O) y dióxido de carbono (CO2).
Luego:
los reactivos son CH4 y O2, y
los productos son H2O y CO2
Paso 2:
la ecuación química sin ajustar será:
Paso 3:
Ahora contamos los átomos de cada reactivo y de cada producto y los
sumamos:
Entonces,
una molécula de metano reacciona con dos moléculas de oxígeno para producir dos moléculas agua y una molécula de dióxido de carbono.
una molécula de metano reacciona con dos moléculas de oxígeno para producir dos moléculas agua y una molécula de dióxido de carbono.
Ejemplo 2:
Ecuación balanceada
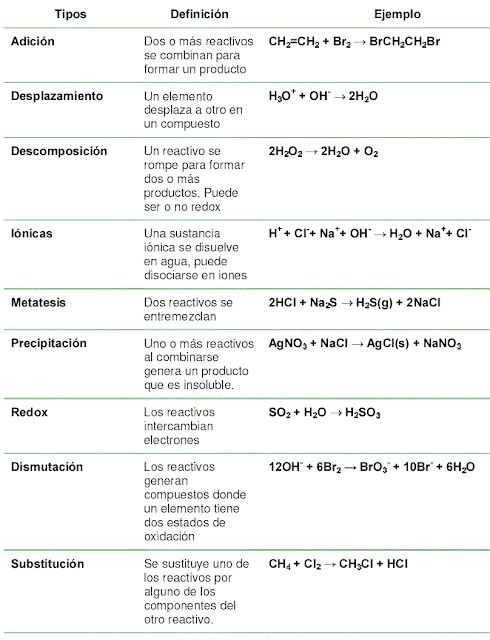
Tipos de reacciones químicas
Estado físico de reactivos y productos
El estado físico de los reactivos y de los productos puede indicarse
mediante los símbolos (g), (l) y (s), para indicar los
estados gaseoso, líquido y sólido, respectivamente.
Por ejemplo:
Para describir lo que sucede cuando se agrega cloruro de sodio (NaCl)
al agua, se escribe:
Dónde ac significa disolución acuosa. Al escribir H2O
sobre la flecha se indica el proceso físico de disolver una sustancia en agua,
aunque algunas veces no se pone, para simplificar.
El conocimiento del estado físico de los reactivos y productos es muy
útil en el laboratorio, Por ejemplo, cuando reaccionan el bromuro de potasio (KBr)
y el nitrato de plata (AgNO3) en medio acuoso se forma un
sólido, el bromuro de plata (AgBr).
Si no se indican los estados físicos de los reactivos y productos, una
persona no informada podría tratar de realizar la reacción al mezclar KBr
sólido con AgNO3 sólido, que reaccionan muy lentamente o no
reaccionan.










No hay comentarios :
Publicar un comentario