GAS IDEAL
Según el diagrama
de fases, la mayor parte de los elementos químicos y las sustancias pueden existir en
tres estados, esto es: sólido, líquido y gaseoso. Y cada uno de nosotros puede
muy fácilmente determinar esos estados solo observando el comportamiento cuando
nos enfrentamos a una sustancia.
Cada uno de los estados, ha sido estudiado durante años por los hombres de ciencia, con el objetivo de determinar las leyes físicas que puedan predecir su comportamiento con el cambio de las circunstancias que lo rodean. En este caso nos ocuparemos de los gases.
Empezaremos por definir que es un gas.
Cada uno de los estados, ha sido estudiado durante años por los hombres de ciencia, con el objetivo de determinar las leyes físicas que puedan predecir su comportamiento con el cambio de las circunstancias que lo rodean. En este caso nos ocuparemos de los gases.
Empezaremos por definir que es un gas.
El gas
La
definición de un gas puede ser muy simple y reducirse solo a decir:
"Un
gas es una sustancia cuyo volumen es igual al volumen del recipiente que lo
contiene".
Esto es cierto, los gases se expanden hasta ocupar todo el volumen del recipiente que lo contiene, pero ese efecto no es único. Si inyectamos a muy alta velocidad un líquido por un pequeño orificio para formar un aerosol dentro de un volumen vacío, las pequeñas y rapidísimas partículas de líquido, también terminarán por ocupar todo el volumen formando una niebla, por lo que a nuestra escueta definición hay que agregarle algo para evitar la confusión. Podemos tratar de arreglar este problema agregando que Pero bueno... el líquido también está formado por muchas moléculas, así que aún no está resuelto del todo, nos falta aun algo, por eso agregamos que:
"las
moléculas se mueven en todas direcciones"
Cosa que no sucede en el líquido del aerosol, donde el grupo de moléculas que forman la partícula se mueven todas en la misma dirección debido a la interacción molecular que mantienen, y que a su vez impide la libre expansión. Al parecer ahora si ya tenemos definido el gas, pero para que esta última condición se cumpla debe cumplirse a su vez que:
"el
tamaño de la molécula debe ser despreciable, comparado con la distancia entre
ellas"
De forma tal que esa enorme distancia relativa, hace que no haya interacción, y que esta solo se limite a su choque físico eventual. Finalmente un gas es entonces una sustancia que cumple con las condiciones siguientes:
·
Está
formado por un gran número de moléculas.
·
La
interacción entre las moléculas se reduce solo a su choque.
En la realidad, estas condiciones se
cumplen con suficiente aproximación, en todos los gases a las condiciones
normales de presión y temperatura como para ser consideradas ciertas, pero
¿qué pasa si el gas se somete a muy elevadas presiones?, por ejemplo
reduciendo notablemente el recipiente que lo contiene. Resula claro que en
tal caso, la distancia entre las moléculas se reduce (ya que el gas es
compresible) y su interacción comienza a tener más y más influencia en el
comportamiento, a medida que más y más se aumente la presión. Como
consecuencia del incremento progresivo de la presión nuestro gas va
apartándose de la definición de gas que hemos establecido, por tal motivo y
debido a que un gas puede ser "más o menos gas" se establece un
"patrón de gas" que servirá para sentar las leyes del
comportamiento de todos los gases y que podrá ser usada con suficiente
aproximación en la mayor parte de las aplicaciones prácticas, este patrón se
llama gas ideal.
El gas ideal
Para definir un patrón de gas que
sirva para establecer reglas de comportamiento se crea el concepto de gas
ideal, este gas ideal cumple las condiciones siguientes:
·
Está
formado por moléculas.
·
La
interacción entre las moléculas se reduce solo a su choque.
·
Los choque
son instantáneos (el tiempo durante el choque es cero).
Los gases reales, siempre que no
estén sometidos a condiciones extremas de presión y temperatura, cumplirán
muy aproximadamente las reglas establecidas para los gases ideales.
|
|
Las leyes de los gases ideales
Se han
desarrollado leyes empíricas que relacionan las principales variables de un gas
en base a las experiencias de laboratorio realizadas. En los gases ideales,
estas variables incluyen la presión (p), el volumen (V) y la
temperatura (T).
1.- La ley de Boyle - Mariotte: Esta ley dice que, si se mantiene la temperatura constante, cuando se aumenta la presión de un gas ideal, desde P1 hasta P2 su volumen disminuye en la misma proporción desde V1 a V2. Esta condición expresada matemáticamente es:
1.- La ley de Boyle - Mariotte: Esta ley dice que, si se mantiene la temperatura constante, cuando se aumenta la presión de un gas ideal, desde P1 hasta P2 su volumen disminuye en la misma proporción desde V1 a V2. Esta condición expresada matemáticamente es:
P1 . V1
= P2 . V2.
El significado de la ley en la práctica es, por ejemplo, que cuando se reduce a la mitad el volumen que ocupa un gas, su presión se duplica, y vice versa. Es decir P es inversamente proporcional a V o también P es proporcional a 1/V a temperatura constante.
Entonces ¿qué sucede si aumentamos al doble la cantidad de gas que esta confinado a un volumen fijo?. De acuerdo a la ley de Boyle-Mariotte la presión también se duplica ya que equivale a haber reducido a la mitad el volumen del gas. Llamemos n a la cantidad de gas (que usualmente se expresa en moles) de modo que esta ley también puede enunciarse matemáticamente, si el volumen es fijo, como:
P es
proporcional a n
2.- La ley de Gay-Lussac: Según esta ley, si se mantiene la presión constante, el volumen del gas aumentará en la misma proporción en que aumente su temperatura absoluta (T):
Igual que
para la ley anterior se puede enunciar matemáticamente, si no cambia el
volumen, como:
V
es proporcional a T
3.- La ley de Charles: Esta ley dice que si se mantiene el volumen constante, la presión de un gas aumenta en la misma proporción en la que aumenta su temperatura absoluta:
Lo que dicho en otras palabras significa que P
es proporcional a T si el volumen no cambia.
En resumen tenemos:
P es proporcional a 1/V
P es proporcional a T
P es proporcional a n
Si combinamos las tres leyes en una sola expresión:
En resumen tenemos:
P es proporcional a 1/V
P es proporcional a T
P es proporcional a n
Si combinamos las tres leyes en una sola expresión:
Para convertir la expresión de proporcionalidad
anterior a una igualdad debemos introducir una constante de modo que:
La constante ha sido determinada
experimentalmente, se llama constante del gas ideal, o constante
universal de gases y se representa como R de modo que finalmente
tenemos:
Donde R = 0.0821 L‧atm/K‧mol
La expresión 3 se denomina ecuación de gases ideales e indica matemáticamente la relación entre presión, temperatura, volumen y cantidad de gas para gases ideales.
Note que para usar la expresión, la temperatura debe estar en K, el volumen en litros y la cantidad de gas en moles, de esta forma la presión resulta en atmósferas.
La expresión 3 se denomina ecuación de gases ideales e indica matemáticamente la relación entre presión, temperatura, volumen y cantidad de gas para gases ideales.
Note que para usar la expresión, la temperatura debe estar en K, el volumen en litros y la cantidad de gas en moles, de esta forma la presión resulta en atmósferas.
LEY COMBINADA
Esta ley establece como enunciado:
"El volumen ocupado por una masa gaseosa, es
inversamente proporcional a las presiones y directamente proporcional a las
temperaturas absolutas que soportan"
Observa
la siguiente imagen a través de la cual se comprueba el enunciado de la
presente ley:
De
acuerdo con el enunciado, se puede establecer la siguiente expresión
matemática:
V1
. P1 = V2 . P2
T1
T2
En
donde:
V=
Volumen
P=
Presión
T=
Temperatura
1.
Una masa gaseosa ocupa u volumen de 2,5 litros a 12 °C y 2 atm de presión.
¿Cuál es el volumen del gas si la temperatura aumenta a 38°C y la presión se
incrementa hasta 2,5 atm?
· Primer paso:
identificar los datos que brinda el enunciado.
V1= 2,5 L
T1= 12 °C
P1= 2 atm
T2= 38 °C
P2= 2,5 atm
· Segundo paso:
Conocer la incognita.
V2= ?
· Tercer paso:
Despejar V2 de la expresión V1 . P1 = V2 . P2 ,
quedando así:
T1
T2
V2= V1 . P1 . T2
T1 . P2
· Cuarto paso: Transformar
las unidades de temperatura (°C) a Kelvin.
T1: K= °C +
273
T2: K= °C + 273
K=
12 + 273= 285 K K=
38 + 273= 311 K
· Quinto Paso: Sustituir los
datos en la expresión y efectuar los calculos matemáticos.
V2= 2,5 L . 2 atm . 311 K
285
K . 2,5 atm
Se cancelan las unidades de presión y temperatura
(atm y K), se obtiene el resultado.
V2= 2,18 L
LEY DEE DALTON
Esta ley establece como enunciado:
"La presión total de una mezcla es igual a la
suma de las presiones parciales que ejercen los gases de forma
independiente"
Observa la siguiente imágen, a través de la cual se
puede comprobar el enunciado de ésta ley
De
acuerdo con el enunciado de ésta ley, se puede deducir la siguiente expresión
matemática:
Ptotal=
P1 + P2 + P3 + ....
En
donde: P1, P2, P3, ... = Se refiere a las presiones parciales de
cada gas.
Para
hallar la presión parcial de cada gas en una mezcla, es necesario multiplicar
la presión total por la fracción molar respectiva al gas. Estableciendo la
siguiente expresión matemática:
Pparcial=
X(gas) . Ptotal X= Fracción Molar
Observa
el siguiente ejemplo:
1.
Una muestra de aire solo contiene nitrógeno y oxígeno gaseoso, cuyas presiones
parciales son 0,80 atmósfera y 0,20 atmósfera, respectivamente. Calcula la
presión total del aire.
· Primer paso: Identificar los datos que brinda el
enunciado.
P(N)=
0,80 atm
P(O)=
0,20 atm
· Segundo paso: Conocer la incognita o interrogante.
Ptotal=
?
· Tercer paso: Sustituir los datos en la expresión
matemática y efectuar el calculo.
Pt= P(N) + P(O)
Pt= 0,80 atm + 0,20 atm
Pt= 1 atm




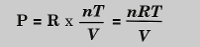



...viaje interestelar aceleración constante (Tierra dentro de 500 M de años)... al principio el Sol fusionando su Hidrógeno, temperatura suya, cuantos + protones núcleos de H fusiona, + núcleos de Helio se producen que al ser más pesados se van concentrando en el centro aumentando densidad, presión y temperatura del núcleo estelar (a esas exorbitantes presiones y temperaturas el He, protones y electrones están degenerados: la materia degenerada es muy conductora del calor compuesta de electrones, protones, neutrones, o quizás incluso quarks en vez de moléculas y por ello ahí no se cumple la Ley de Boyle-Mariotte y ese aumento de temperatura por la contracción del núcleo no produce aumento de volumen que tampoco disminuye ya por efectos cuánticos y se comporta más como un sólido y solo aumenta la presión, Densidad y temperatura) donde los electrones sueltos se van comprimiendo y apelotonando, más presión y temperatura provoca aumento fusión de H y fuerza expansiva, para no aplastarse por la mayor fuerza de contracción gravitatoria de un núcleo cada vez más denso las estrellas empiezan cada vez a fusionar más H que antes, o lo que estén fusionando He C N O etc, para mantener el equilibrio contracción gravitatoria/expansión térmica acelerando su fin... Por eso las supergigantes solo duran 10 millones de años en vez de los 10000 millones del Sol...
ResponderEliminar...aumentando así progresivamente su temperatura durante unos miles de millones de años hasta el fin del H en el núcleo que se apaga, empieza a comprimirse y durante unos cientos de millones de años el Sol se inflará como gigante roja, gran pérdida de masa de H y He que "vuelan" en ascendencias térmicas y son eyectados fuera por convección; alejándose alguna franja habitable a entre 2 y 9 UA, fusionando ahora H del exterior del candente núcleo que le irradia su calor ahí fuera gana la expansión, el candente núcleo que sigue comprimiéndose, limitada por el pelotón de electrones y He degenerados a esa gran densidad, y calentándose... al alcanzar ~10^8 kelvin el núcleo se enciende empieza ya a fusionar su He: fuerte convección turbulenta; limitada por el pelotón de electrones y He degenerados que son regenerados al disminuir la densidad con la expansión, pelotón que actúa como escudo evitando que la estrella se despedace en la explosión inicial del He energía que se absorbe en volver el núcleo a materia regenerada; que deshace la hasta ahora ordenada atmósfera recomponiéndola terminando la etapa de gigante roja...
Eliminar...preparado ya el Sol fusionando ahora He para ofrecer otros de cien a mil millones de años de habitabilidad en alguna franja a entre 7 y 22 UA en esa aún más alejada franja habitable "ricitos de oro"... y después ya otra historia: mientras la estrella brille, secuencia principal, gigante roja, fusionando He, enana blanca, "el Terraformado Planeta Alegría de la enana roja Trappist-1 estrella fría" vale orbitándola ± lejos...antes durante la secuencia principal con el paso del tiempo el Sol cada vez a + ºC... Dentro de 500 Millones de años el Sol fusionando más H y con más brillante luminosidad, muy alta temperatura en Tierra... Para entonces Humanidad ya con Inmortalidad Tecnológica y Enorme Progreso Científico-Tecnológico que es exponencial: cuanto más se progresa más rápido se progresa, para Emigrar donde quiera: "La Tierra es la cuna de la razón pero es imposible vivir eternamente en una cuna" (Konstantín E. Tsiolkovski)... Exo-planetas...solo llevamos la Verdad...allá vamos...goooooo►...
EliminarLibro "El Asteroide del Fin del Mundo"
Eliminar...Tractor-Gravitatorio: componiendo un satélite de Agua en órbita. Astronautas ensamblan una *estructura inicial* que tan pequeña y ligera de Ángulos Metálicos unidos con Tornillos, después rellenándola con Globos vacíos de "1 mt" hechos de kevlar, grafeno, y ya Atados en su sitio LLenándolos de AGUA desde una nave-espacial cisterna. Colocando esa primera formación ya en su adecuada órbita... Y por fuera ir poco a poco Atando entre sí en sus orejetas y LLenando más y más Globos "hasta que se quiera", reforzando cada varias capas de Globos con redes fuertes de "plástico", formando una figura de Globos como un "racimo de uvas", ir Atornillando y sacando desde la *estructura inicial* hacia el exterior siempre más Listones de Ángulos Metálicos para instalar como superficie final una Plataforma donde "aterrizar", empujar con un cohete, etc... Si alguna vez el "Bunch-1" se viniera contra la Tierra, en la reentrada con el calor se sueltan los "miles" de Globos, se separan y se les funde el hielo más fácilmente. Todos los amarres deben ser fusibles por el calor y en el centro del "racimo" un "disgregador" como el de los sistemas de eyección de asiento en los aviones, que se active automático con el calor de "esa" reentrada.
Eliminar...frenando a un asteroide (el método más expeditivo: colocar "las nucleares" muy cerca de la superficie... "Boom!", en el Espacio, al no haber aire, lo único que le llega es la radiación que volatiliza el material del punto de impacto y produciendo un chorro a reacción que cambia su órbita)... (libro "El Asteroide del Fin del Mundo")
EliminarEste comentario ha sido eliminado por el autor.
Eliminar(moviendo asteroides: pag. 135-138)
Eliminar...viaje interestelar constante aceleración (contra alzheimer y depresión)... consejo tonyon: estar todo el día cantando alegres canciones mentalmente en silencio.
ResponderEliminaratención toda jubilación: ir al médico Vacuna Herpes Zóster evita Alzheimer 20% casos
Eliminar...viaje interestelar aceleración constante (con Karolina Protsenko)... Karolina deberían hacerte un monumento en Sta. Monica: un Ángel que toca el violín. (Karolina Protsenko 2025. Youtube).
EliminarEste comentario ha sido eliminado por el autor.
ResponderEliminar(Luz Sólida: un supersólido que fluye como un líquido sin fricción): el "Río con Retorno"
ResponderEliminar(2)...viaje interestelar aceleración constante (sin tonterías relativistas: miles G)... ni las Masas ni las Órbitas de Marte y la Tierra son iguales. Por tanto las diferentes Aceleraciones que experimentan ambos planetas en sus afelios y perihelios hacen que No "el Tiempo" sino "la Maquinaria" del reloj que mide su transcurso cambie. Aunque sea un reloj atómico, los electrones tienen masa y se ven afectados por esas aceleraciones cambiando no "el Tiempo" sino su medición. Ese Universo relativista no Infinito sino "curvo", con el cuento de que si vas en línea recta y pasas la curva "frontera" al otro lado hay "Nada". La Nada es lo único que no podemos ni siquiera imaginar, ¿sería esa "Nada" relativista tal vez un inmenso espacio relleno de turrón de Alicante? La velocidad no cambia el Tiempo, lo que cambia el ritmo de "la maquinaria" del reloj que lo mide son las fuerzas de Aceleración. Realmente es el Tiempo el que dará o quitará razones.
ResponderEliminarEste comentario ha sido eliminado por el autor.
Eliminar(3a)...viaje interestelar constante aceleración (hipótesis tonyon)... "la velocidad orbital de los electrones varía inversamente a la aceleración", gravitatoria o de movimiento... con los futuros Transformadores Gravitatorios: qué pasaría si... Nave Estelar a 1 Millón G... Áreas Habitables: 1M-g de aceleración constante hacia el suelo ↓↓motores↓↓ (-) 999 999g de aceleración constante hacia el techo ↑↑transformadores gravitatorios↑ = 1g de aceleración constante hacia el suelo↓... Áreas habitables: 2 relojes atómicos fuera y 2 dentro. Los 2 dentro funcionan a 1g normalmente. Los 2 de fuera a 1M-g... quizás sus electrones se quedarían parados en sus órbitas: Los 2 relojes de fuera se pararían, no "el Tiempo" de fuera sí y el de dentro no. Si la atracción electromagnética protón/electrón fuera más fuerte que las fuerzas de la enorme aceleración sobre los electrones, los electrones caerían al núcleo atómico quedando los átomos con sus electrones parados pegados al núcleo... Sin electrones de valencia ya no hay moléculas... Qué pasaría con la estructura de la Nave ("eso es la Materia, sobre todo espacio vacío") ya de Materia formada por átomos con los electrones parados en sus órbitas, o por átomos con sus electrones parados y pegados al núcleo: la estructura de la Nave se derrumbaría como arena sin cemento... Para evitar el "efecto aceleración" poner los Transformadores Gravitatorios en TODA la estructura de la Nave, no solo en las áreas habitables. Así la Nave entera siente 1g aunque vaya a 1M-g, (1Mega-g).
ResponderEliminar