SOLUCIONES
Una solución (o disolución) es
una mezcla de dos o más componentes, perfectamente homogénea ya que cada
componente se mezcla íntimamente con el otro, de modo tal que pierden sus
características individuales. Esto último significa que los constituyentes son
indistinguibles y el conjunto se presenta en una sola fase (sólida, líquida
o gas) bien definida.
Una solución que contiene agua
como solvente se llama solución acuosa.
Si se analiza una muestra de
alguna solución puede apreciarse que en cualquier parte de ella su composición
es constante.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida. Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Las mezclas de gases, tales como
la atmósfera, a veces también se consideran como soluciones.
Las soluciones son distintas de
los coloides y de las suspensiones en que las partículas del
soluto son de tamaño molecular y están dispersas uniformemente entre las
moléculas del solvente.
Las sales, los ácidos, y las bases
se ionizan cuando se disuelven en el agua
Características de las soluciones
(o disoluciones):
I) Sus componentes no pueden
separarse por métodos físicos simples como decantación, filtración,
centrifugación, etc.
II) Sus componentes sólo pueden
separase por destilación, cristalización, cromatografía.
III) Los componentes de una
solución son soluto y solvente.
Soluto
es aquel componente que se encuentra en menor cantidad y es el que se
disuelve. El soluto puede ser sólido, líquido o gas, como ocurre en las
bebidas gaseosas, donde el dióxido de carbono se utiliza como gasificante
de las bebidas. El azúcar se puede utilizar como un soluto disuelto en líquidos
(agua).
Solvente
es aquel componente que se encuentra en mayor cantidad y es el medio que
disuelve al soluto. El solvente es aquella fase en que se encuentra
la solución. Aunque un solvente puede ser un gas, líquido o sólido, el
solvente más común es el agua.
IV) En una disolución, tanto el
soluto como el solvente interactúan a nivel de sus componentes más pequeños
(moléculas, iones). Esto explica el carácter homogéneo de las soluciones y la
imposibilidad de separar sus componentes por métodos mecánicos.
Mayor o menor concentración
Ya dijimos que las disoluciones
son mezclas de dos o más sustancias, por lo tanto se pueden mezclar agregando
distintas cantidades: Para saber exactamente la cantidad de soluto y de
solvente de una disolución se utiliza una magnitud denominada
concentración.
Dependiendo de su concentración,
las disoluciones se clasifican en diluidas, concentradas, saturadas,
sobresaturadas.
Diluidas: si la cantidad de soluto respecto del solvente es pequeña.
Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas: si la proporción de soluto con respecto del solvente es
grande. Ejemplo: una disolución de 25 gramos de sal de mesa en 100
gramos de agua.
Saturadas: se dice que una disolución está saturada a una determinada
temperatura cuando no admite más cantidad de soluto disuelto. Ejemplo: 36
gramos de sal de mesa en 100 gramos de agua a 20º C.
Si intentamos disolver 38 gramos
de sal en 100 gramos de agua, sólo se disolvería 36 gramos y los 2 gramos
restantes permanecerán en el fondo del vaso sin disolverse.
Sobresaturadas: disolución que contiene mayor cantidad de soluto que la
permitida a una temperatura determinada. La sobresaturación se produce por
enfriamientos rápidos o por descompresiones bruscas. Ejemplo: al sacar el
corcho a una botella de refresco gaseoso.
Modo de expresar las
concentraciones
Ya sabemos que la concentración de
las soluciones es la cantidad de soluto contenido en una cantidad determinada
de solvente o solución. También debemos aclarar que los términos diluidos o
concentrados expresan concentraciones relativas.
Las unidades de concentración
en que se expresa una solución o disolución pueden clasificarse en unidades
físicas y en unidades químicas.
Unidades físicas de concentración
Las unidades físicas de
concentración están expresadas en función del peso y del volumen, en
forma porcentual, y son las siguientes:
a) Tanto por ciento peso/peso %P/P
= (cantidad de gramos de soluto) / (100 gramos de solución)
b) Tanto por ciento
volumen/volumen %V/V = (cantidad de cc de soluto) / (100 cc de solución)
c) Tanto por ciento peso/volumen %
P/V =(cantidad de gr de soluto)/ (100 cc de solución)
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de
la solución.
b) Porcentaje volumen a volumen (% V/V): se
refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
c) Porcentaje peso a volumen (% P/V): indica el número de
gramos de soluto que hay en cada 100 ml de solución.
Ejercicio:
Se tiene un litro de solución al
37%. ¿Cuántos litros de agua se tienen que agregar para que quede al 4%?
Resolvamos:
El problema no indica las
unidades físicas de concentración. Se supondrá que están expresadas en % P/V.
Datos que conocemos: V =
volumen, C= concentración
V1 = 1 litro
C1 =
37%
37% P/V = significa que
hay 37 gramos de soluto en 100 ml de solución (solución = soluto + solvente).
C2 = 4%
V2 = ¿?
Regla para calcular disoluciones o
concentraciones
V1 • C1
= V2 • C2
Puede expresarse en: %
P/V
Reemplazando los datos que se
tienen del problema, se obtiene:
Entonces, si
tenemos un litro de solución al 37%; para obtener una solución al 4% es
necesario tener un volumen de 9,25 litros; por lo tanto, para saber cuántos
litros de agua hay que agregar al litro inicial, hacemos:
V2 – V1 = Volumen de
agua agregado
9,25 –
1 = 8,25 litros
Respuesta: Se deben agregar 8,25 litros de agua
Unidades químicas de concentración
Para expresar
la concentración de las soluciones se usan también sistemas con unidades
químicas, como son:
a) Fracción
molar
b) Molaridad M
= (número de moles de soluto) / (1 litro de solución)
c) Molalidad m
= (número de moles de soluto) / (1 kilo de solvente)
a) Fracción
molar (Xi): se define como la relación
entre los moles de un componente (ya sea solvente o soluto) de la solución y
los moles totales presentes en la solución.
Ejercicio:
Se agregan 3 gramos de sal en una
cacerola con 4 litros de agua ¿cuál es la concentración de sal?, o dicho de
otra forma ¿cuál es la concentración de la solución?
Calcular la fracción molar de
solvente y de soluto: Recordemos que la fracción molar expresa la concentración
de una solución en Moles de Soluto o de Solvente por Moles Totales de la
Solución.
Solvente: agua (H2O)
Soluto: sal (NaCl)
Datos que conocemos: 3 gramos de soluto y 4.000 cm3 (4 litros) de solvente.
Con estos datos debemos resolver
el problema, calculando 4 valores significativos: moles de solvente, moles
de soluto, fracción molar de solvente y fracción molar de soluto.
Para el agua, se conoce su masa
molar = M(H2O) = 18 g/mol (1 mol de H2O contiene 18 g,
formados por 2 g de H y 16 g de O).
Averiguar cuántos moles de
solvente H2O) tenemos:
Para la sal (NaCl) su masa molar =
M(NaCl) = 58,5 g/mol (1 mol de sal equivale a 58,5 g, formados por 23 g de Na y
35,5 g de Cl)
Averiguar cuántos moles de soluto
tenemos:
Ahora que conocemos la cantidad de
moles de solvente y la cantidad de moles de soluto, podemos calcular las
fracciones molares de solvente y de soluto:
Fracción
molar del solvente = Xsolvente
Fracción molar del solvente (agua)
= 0,99977
Fracción molar del soluto= Xsoluto
Fracción molar del soluto= 0,00023
Pero sabemos que:
Entonces: 0,99977 + 0,00023 = 1
b) Molaridad (M): Es el número de moles de soluto contenido en un litro de
solución. Una solución 4 molar (4 M) es aquella que contiene cuatro moles de
soluto por litro de solución.
Ejercicio:
¿Cuál será la molaridad de
una solución que contiene 64 g de Metanol (masa molar del metanol 32 gr/mol) en
500 ml de solución?
Datos conocidos: metanol 64 g
Masa molar del metanol: 32 g/mol
Masa de la solución: 500 ml (0,5
litro)
Primero calculamos la cantidad de
moles que hay en 64 g de metanol.
Si un mol de metanol equivale a 32
g, 64 g equivalen a 2 moles (64/32=2)
Aplicamos la fórmula:
c) Molalidad
En primer lugar debemos advertir
que molalidad no es lo mismo que molaridad por lo cual
debemos evitar confundirlas puesto que el nombre es muy parecido pero en
realidad cambian mucho los cálculos, y es un grave error pero muy frecuente.
En la molalidad
relacionamos la molaridad del soluto con el que estamos trabajando con
la masa del disolvente (en kg) que utilizamos.
La definición de molalidad
es la siguiente:
Relación entre el número de moles
de soluto por kilogramos de disolvente (m)
Solubilidad
En química,
la solubilidad mide la capacidad de una determinada sustancia para disolverse
en un líquido.
Algunos
líquidos, tales como agua y alcohol, pueden ser disueltos en cualquier
proporción en otro solvente. Sin embargo, el azúcar tiene un límite de
solubilidad ya que al agregar cierta cantidad adicional en una solución está
dejará de solubilizarse, llamándose a esta solución saturada.
Es la
proporción en que una cantidad determinada de una sustancia se disolverá en una
cantidad determinada de un líquido, a una temperatura dada.
En términos
generales, es la facilidad con que un sólido puede mezclarse homogéneamente con
el agua para proporcionar una solución química.
Concepto
La solubilidad
es la mayor cantidad de soluto (gramos de sustancia) que se puede disolver en
100 gramos (g). de disolvente a una temperatura fija, para formar una
disolución saturada en cierta cantidad de disolvente.
Las
sustancias no se disuelven en igual medida en un mismo disolvente. Con el fin
de poder comparar la capacidad que tiene un disolvente para disolver un
producto dado, se utiliza una magnitud que recibe el nombre de solubilidad.
La capacidad
de una determinada cantidad de líquido para disolver una sustancia sólida no es
ilimitada. Añadiendo soluto a un volumen dado de disolvente se llega a un punto
a partir del cual la disolución no admite más soluto (un exceso de soluto se
depositaría en el fondo del recipiente). Se dice entonces que está saturada.
Pues bien, la
solubilidad de una sustancia respecto de un disolvente determinado es la
concentración que corresponde al estado de saturación a una temperatura dada.
Las
solubilidades de sólidos en líquidos varían mucho de unos sistemas a otros. Así
a 20º C la solubilidad del cloruro de sodio (NaCl) en agua es 6 M (molar) y en
alcohol etílico (C2H6O), a esa misma temperatura, es
0,009 M (molar). Cuando la solubilidad es superior a 0,1 M (molar) se suele
considerar la sustancia como soluble en el disolvente considerado; por debajo
de 0,1 M (molar) se considera como poco soluble o incluso como insoluble si se
aleja bastante de este valor de referencia.
La
solubilidad depende de la temperatura; de ahí que su valor vaya siempre
acompañado del de la temperatura de trabajo. En la mayor parte de los casos, la
solubilidad aumenta al aumentar la temperatura.
Factores que
determinan la solubilidad
Solubilidad
en líquidos: al elevar la temperatura aumenta
la solubilidad del soluto gas en el líquido debido al aumento de choques entre
moléculas contra la superficie del líquido. También ocurre lo mismo con la
presión.
Solubilidad
de líquidos en líquidos: Al aumentar
la temperatura aumenta la solubilidad de líquidos en líquidos. En este caso la
solubilidad no se ve afectada por la presión.
Solubilidad
de sólidos en líquidos: la variación
de solubilidad está relacionada con el calor absorbido o desprendido durante el
proceso de disolución. Si durante el proceso de disolución se absorbe calor la
solubilidad crece con el aumento de la temperatura, y por el contrario, si se
desprende calor durante el proceso de disolución, la solubilidad disminuye con
la elevación de temperatura. La presión no afecta a la solubilidad en este
caso.
Unidades de
medida
Puesto que la
solubilidad es la máxima concentración que puede alcanzar un soluto, se medirá
en las mismas unidades que la concentración.
Es habitual
medirla en gramos de soluto por litro de disolución (g/l) o en gramos de soluto
por cada 100 cc de disolución (%).
Aunque la
unidad de medida se parezca a la de la densidad, no es una medida de densidad.
En la densidad, masa y volumen se refieren al mismo cuerpo. En la solubilidad,
la masa es de soluto y el volumen es de la disolución, de la mezcla de soluto y
disolvente.





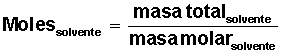





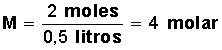
No hay comentarios :
Publicar un comentario